1. 動脈硬化とは?
動脈硬化とは、簡単にいうと、動脈の壁が厚くなり、硬くなることです。中高年の人に生じる病態と思われがちですが、実は小児期から徐々に進行し、さまざまな病気の原因となります。そのため若いときから動脈硬化が進むのを予防することが大切です。
動脈硬化は、以前は知らず知らずのうちに血管に過剰な脂質がたまってできていくものとされていました。しかし最近ではメタボリックシンドローム*などによって血管に慢性的な炎症が生じ、血管壁が厚くなったり硬くなったりするなど、いろいろな要因が絡み合って発症する病態であることが明らかになっています。また、血管は単に支持組織**としての役割を果たしているだけでなく、多くの物質を分泌したり受け取ったりして、他の細胞や組織と連携しているたいへん重要な組織であることがわかってきました。
日本では2019年12月に「健康寿命の延伸等を図るための脳卒中、心臓病その他の循環器病に係る対策に関する基本法」(脳卒中・循環器病対策基本法)が施行されました。この法律では、国民は生活習慣等が脳卒中や循環器病の発症に及ぼす影響について正しい知識をもち、日常生活においてこれらの病気の予防に努めなければならないとされています。この義務を果たすためにも、脳卒中や心臓病などの原因となる動脈硬化が進むのを防ぐことが重要といえるでしょう。
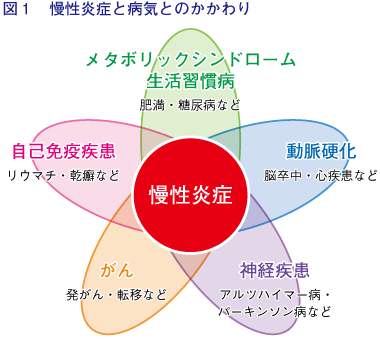
世界保健機関(WHO)は、生活習慣病やがんなどを総称して「非感染性疾患(non-communicable disease: NCD)」と定義し、医学・保健衛生上の重要課題と位置付けています。かつて悪性腫瘍と循環器疾患とは、それぞれ個別に扱われてきましたが、発がん患者の救命率の改善や、抗がん剤の循環器系への影響などを背景として、がん患者の予後やQOL***の改善を目標として、2018年に日本腫瘍循環器学会が設立されました。
さらに、生活習慣病とがんには慢性炎症という共通の基盤があり、どちらも加齢とともに有病率が上昇することから、互いに影響し合っているのではないかと考えられています。ごく低レベルの炎症反応が長年にわたって続くことで生じる動脈硬化は、いわば非感染性疾患の中心的な位置を占める病態といえるかもしれません。
(注)
*メタボリックシンドローム:内臓脂肪型肥満に高血圧、高血糖、脂質代謝異常が組み合わさって、心臓病や脳卒中などを引き起こす病態。
**支持組織:骨や軟骨など、体を支えるための組織。
***QOL:クオリティ・オブ・ライフ(quality of life)の略で「生活の質」と訳すこともある。単に病気の有無だけでなく、「生きがいを感じているか」「日々の生活に満足しているか」までを含めた考え方。
2. 動脈硬化のしくみは?
血管の構造
動脈も静脈も、内膜、中膜、外膜という3つの層からできています。血液と接しているのが内膜で、その表面は内皮細胞に覆われています。動脈硬化に最も関係してくるのが内膜と内皮細胞です。
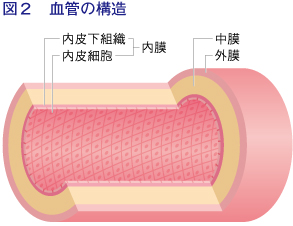
内皮細胞の役割は多岐にわたります。血管の収縮・拡張を調節するほか、血管透過性*を調節したり、血栓がつくられるのを防いだりしています。さらに、免疫系への関与などが知られています。内皮細胞は、健康な状態では血管の恒常性維持に貢献していますが、病的状態になると、逆に病態を悪化させるのが特徴です。動脈硬化は、内皮細胞のはたらきが低下することで始まります。弱った内皮細胞のすき間にコレステロールが入り込んで動脈硬化が進んでしまうのです。
中膜は、血管の弾力性を保つ血管平滑筋細胞で構成されています。血管の走行に対してらせん状になっており、平滑筋が収縮すると血管内腔が狭くなります。動脈では、心臓から血液が送り出されるときに高い圧力がかかるので、この層が厚くなっていますが、静脈では圧が低いため、この層が薄くなっています。
外膜は結合組織で構成され、外部から血管を守っています。線維芽細胞やマクロファージを含み、交感神経によって支配されています。また、径が数mm以上の動脈の外膜には、栄養分を血管壁へ届けるための細い血管が張り巡らされています。最近では、外膜に幹細胞や前駆細胞**があり、再生などにも役立っているのではないかと考えられています。
(注)
*血管透過性:血管から周りの組織への、水分や栄養分などの移動しやすさ。
**前駆細胞:幹細胞から特定の細胞へと分化する途中段階にある細胞。
動脈硬化の種類と、その原因
動脈硬化には3つのタイプがあります。粥状(じゅくじょう)動脈硬化(アテローム性動脈硬化)、メンケベルク型動脈硬化(中膜硬化)、細動脈硬化です。
メンケベルク型硬化は、おもに四肢動脈、骨盤内動脈、腸間膜動脈などの中膜に石灰化を生じるもので、一般に内腔の狭窄は伴いません。
細動脈硬化は、おもに大脳の深い部分(基底核部)に分布する径0.2mm程度の細い動脈に見られます。中膜の壊死ないし細胞死によって血管壁が薄くなり、一部分が膨れ上がって小動脈瘤を形成するもので、高血圧が原因です。高血圧が改善されれば、線維芽細胞によって障害された血管が修復されますが、治療が不十分な場合は脳出血を生じたり、線維芽細胞の増殖が止まらずに血管内腔がすべて覆われてしまったりします。これが「ラクナ梗塞」と呼ばれるもので、日本人に多く、小さな梗塞が多発する特徴があります。
一般に動脈硬化といえば、粥状動脈硬化(アテローム性動脈硬化)を指すことが多く、以下ではこのタイプに焦点を当てて説明します。血管壁におかゆのような粥腫(アテローム)がつくられた状態で、内膜や中膜がよく発達した動脈に起こりやすく、心臓の冠動脈、大動脈、脳・頸部・腎臓・四肢の動脈などでよく発生します。このため、狭心症や心筋梗塞、脳梗塞、大動脈瘤、腎梗塞、手足の壊死などにつながるのです。
従来、動脈硬化は血管壁に脂質が沈着して生じるものと考えられてきましたが、最近の研究では傷害反応仮説が有力になっています。これは血管内に常に存在する細胞群と、病態に応じて出てくる細胞群との複雑な相互作用によって動脈硬化が起こってくるというものです。
血圧の上昇などなんらかの原因で血管内皮細胞が傷つくと、内皮細胞の裏側に、いわゆる悪玉のLDLコレステロール*(LDL-C)が入り込みます。それが酸化変性され酸化LDLになると、酸化LDL受容体を介して内皮細胞へ取り込まれ、内皮の傷害が進みます。また、マクロファージが酸化LDLを貪食して泡沫細胞に変化し、内膜の裏側に蓄積します。こうして、動脈硬化巣(プラーク)の中心となる脂質コアが形成され、血管の内腔が狭くなります。
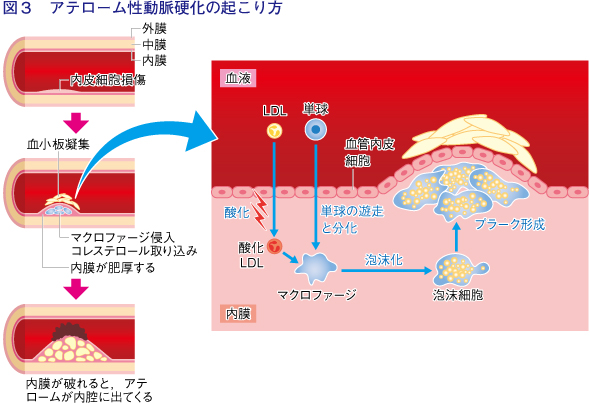
このプラークが徐々に増大し、慢性的な炎症も続くと被膜が薄くなり、不安定プラークとなって、破裂のリスクが高まります。プラークの破裂は急性心筋梗塞などの心血管疾患につながりますが、プラークが破裂するまでは無症状で進行することが少なくありません。ですので、この破裂のプロセスを予防することが動脈硬化治療のポイントとなります。破綻しやすいプラークは、脂質の占める部分が多く黄色いという特徴があります。一方、脂質や炎症細胞が少なく、厚い被膜をもつ白色プラークは破綻しにくいと言われています。こうした知見に基づいて、プラークが破綻しないようにするさまざまな治療法が開発されています。
(注)
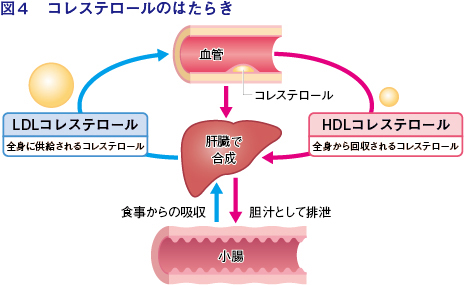
*コレステロール:コレステロールはタンパク質と結合し、血流に乗って体の各所へ運ばれる。このとき脂質の割合が少なく比重の大きいものがHDL(いわゆる善玉)、比重の小さいものがLDL(いわゆる悪玉)。HDLコレステロールには血管にある余分なコレステロールを肝臓に運ぶはたらきがあり、LDLコレステロールには肝臓から全身の細胞にコレステロールを届けるはたらきがある。
カルシウムパラドックス
動脈硬化は、文字どおり、血管が硬くなる病態ですが、その重要な役割を果たす因子の一つがカルシウムです。
食生活でカルシウムが不足すると、骨がもろくなることは皆さんご存じのことと思います。閉経後の女性に多い骨粗鬆症はカルシウム不足が大きな原因です。それだけでなく、カルシウムは心筋に作用して心臓の収縮や弛緩に関与する栄養素で、生命の維持に欠かすことができません。
骨粗鬆症や慢性腎臓病の患者さんだけでなく中高年の人でも、骨ではカルシウムが減少しながら、血管にはカルシウムが沈着(石灰化)するという逆転現象が起こります。これが「カルシウムパラドックス」です。プラークの線維性被膜中にある小さな石灰化は、プラーク破裂のリスクを高めます。また、中膜の石灰化は血管の弾力性を減少させ、心血管障害を増加させます。
かつて血管の石灰化は加齢が原因と考えられてきましたが、最近の研究で、中膜を形成する血管平滑筋細胞が分泌する石灰化阻害因子が、異所性*の石灰化を抑制する役割を果たしていることがわかってきました。しかし、脂質異常症、糖尿病、慢性腎臓病、加齢などの動脈硬化リスクがあると、酸化ストレスや慢性炎症を引き起こし、平滑筋細胞の死と石灰化阻害因子の欠乏、平滑筋細胞から骨芽細胞への形質転換ないし細胞老化をきたし、血管の石灰化が進むことになります。
(注)
*異所性:本来あるべきところとは別の部分。
3. 動脈硬化に影響を与えるものは?
動脈硬化を進行させるさまざまな危険因子が知られています。特に脂質異常と、高血圧や高血糖の原因となるメタボリックシンドロームが重要であり、ここではそれらを中心として、主なものについて述べます。
脂質異常症
動脈硬化のしくみで説明したように、血液中の脂質、特にLDL-Cや中性脂肪(TG:トリグリセライド)の増加は、動脈硬化の強い危険因子です。最近では、特に狭心症や心筋梗塞を発症した患者さんの再発防止には、LDL-Cをなるべく低く保つことが推奨されています。末梢血管から余剰のコレステロールを回収するのは、いわゆる善玉のHDLコレステロール(HDL-C)です。そのためHDL-Cが少ないことも、動脈硬化の危険因子となります。
遺伝的にコレステロールが高い家族性高コレステロール血症(FH:familial hypercholesterolemia)が、日本人の200?500人に1人と比較的高頻度に見られます。このような人では、著しい高LDL-C血症が生じ、皮膚の黄色腫やアキレス腱の肥厚があり、しばしば血縁者に虚血性心疾患の患者さんがいます。
脂質異常症の治療にはいくつかの薬剤が用いられています。肝細胞におけるコレステロール合成の律速酵素*はHMG-CoAレダクターゼで、その基質であるHMGと似た構造をもつスタチン系薬剤は、酵素に結合してコレステロール合成を阻害します。すると肝細胞ではLDL受容体の発現が亢進してLDL-Cの取り込みが促進され、血中LDL-Cが低下するのです。スタチンには脂質そのものに対する作用だけでなく、血管内皮の機能改善や動脈硬化プラークの安定化、抗炎症などの作用があり、多面的に動脈硬化の進展を抑制します。スタチン投与に伴う主な副作用は、筋傷害と肝酵素上昇です。
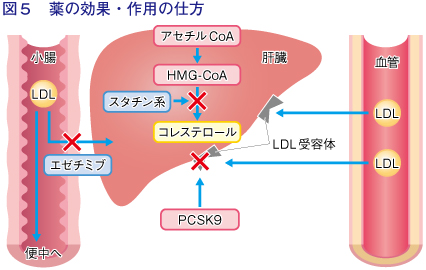
エゼチミブは、小腸壁にあるコレステロールトランスポーターに結合し、食事や胆汁からのコレステロールの吸収を阻害して、血中コレステロールを低下させます。エゼチミブは、スタチンの使用が困難な場合や効果が不十分なときに使用されます。
PCSK9阻害薬は、LDL受容体の分解を促進するPCSK9を阻害する注射剤です。スタチンによりPCSK9が増加するため、LDL受容体の分解が促進され、肝細胞へのLDL-C取り込みが抑えられます。この薬はPCSK9を標的とするヒト型モノクローナル抗体で、LDL受容体の分解を抑制して強力なLDL-C低下効果を発揮します。FHの患者さんにスタチンと併用されるほか、スタチンが使えない場合にも使用されますが、薬価が高いのが難点です。
高TG(中性脂肪)血症に対しては、生活習慣の改善に加えて、古くからフィブラート系薬剤が使われています。この薬は、核内のペルオキシソーム増殖因子活性化受容体(PPAR)αを活性化させて脂肪酸の分解を促します。これによってTGを低下させる一方、HDL-Cを増加させるのです。スタチンと同様、筋傷害と肝酵素上昇の副作用があり、特に腎機能が低下しているときには注意を要します。
さらに、近年開発された選択的PPARαモジュレーターはPPARαの特異的なアゴニスト**で、肝障害や腎障害などの副作用が少なく、脂質異常症や脂肪肝への有効性が高く、高TGや低HDL-Cに対する良好なコントロールが可能になってきています。このほか、魚油に多く含まれる多価不飽和脂肪酸を純化したEPA製剤が、TGを低下させ、動脈硬化の進展を抑える効果があるとして使用されています。
(注)
*律速酵素:複数の化学反応が連続して起こるとき、その全体の反応速度のうち最も進行の遅い反応を触媒する酵素で、そのはたらきが全体の反応の速さを決める。
**アゴニスト:作動薬または作用薬ともいう。アゴニストは受容体と結合して生体機能を活性化させる。
肥満とメタボリックシンドローム
肥満の程度は、BMI(ボディ・マス・インデックス)で評価されます。体重(kg)を身長(m)で2回割ることで算出され、18.5から25までが標準的とされています。肥満は以下に述べるように動脈硬化の危険因子ですが、反対に、特に高齢者では痩せすぎもフレイル(脆弱性)のリスクを高め、注意が必要です。一方、わが国におけるメタボリックシンドロームの診断基準では内臓脂肪蓄積に伴うウエスト周囲長の増大が必須項目となっています。
表1 体格判定基準
| BMI(kg/m²) | 体格判定 |
|---|---|
| 18.5未満 | やせ |
| 18.5~25未満 | 標準 |
| 25~30未満 | 肥満 |
| 30以上 | 高度肥満 |
表2 メタボリックシンドロームの診断基準
| 必須項目 | |
|---|---|
| ウエスト周囲長 | 男性≧85cm、女性≧90cm |
| かつ以下のうち2項目 | |
| 中性脂肪 | 高中性脂肪血症(150mg/dL以上) かつ/または 低HDLコレステロール血症(40mg/dL未満) |
| 血圧 | 収縮期血圧130mmHg以上 かつ/または 拡張期血圧85mmHg以上 |
| 血糖値 | 空腹時血糖110mg/dL以上 または HbA1c5.5%以上 |
脂肪組織は単に中性脂肪を蓄えておくエネルギー貯蔵器官ではなく、1990年以降の研究により、さまざまな生理活性物質を分泌する内分泌器官であることがわかってきました。肥満に伴い脂肪細胞から炎症細胞の走化*因子が分泌され、その結果、脂肪組織に炎症細胞が浸潤することで慢性炎症が生じます。炎症細胞から分泌されるサイトカイン**や、炎症細胞からの刺激によって脂肪細胞から分泌されるアディポサイトカインは、動脈硬化に影響します。
例えばアディポネクチンは、脂肪細胞でつくられるホルモンの一種で、肥満によって血中濃度が低下します。また、アディポネクチンを欠損したマウスでは、脂質異常、高血圧、糖尿病を示すことから、アディポネクチンの低下がメタボリックシンドロームの一因と考えられています。
アディポネクチンは血管壁に直接作用し、炎症やマクロファージの浸潤や泡沫細胞の形成を抑えます。さらに血管内皮細胞の機能を活性化し、血管平滑筋の増殖を抑えることなどから、動脈硬化の進行を食い止める効果があると考えられています。アディポネクチンの受容体は血管やマクロファージのほか、骨格筋や肝臓に現れることから、受容体アゴニストが動脈硬化治療に有用と期待されています。
脂肪細胞から分泌されるレプチンは、中枢神経に現れるレプチン受容体を介して、摂食抑制やあとで述べるインスリン抵抗性の改善などの作用があります。肥満ではレプチンの分泌は増加し、高レプチン血症をきたしますが、レプチン抵抗性によって効果はむしろ弱くなります。
(注)
*走化:免疫を担う白血球は常に血管内を循環しており、白血球が炎症の起きている血管外組織へ出ていくことを走化という。
**サイトカイン:生理活性タンパク質ともいい、細胞から分泌される低分子タンパク質。免疫細胞の活性化や機能抑制に重要な役割を担っている。
高血圧
高血圧は多くの場合、症状がなく経過します。脳卒中や心筋梗塞、心不全、大動脈解離、慢性腎臓病、認知症などの危険因子ですが、いずれも加齢と動脈硬化を基礎とする疾患で、高血圧の治療によりリスクが低減します。高血圧は、径0.2mm程度の動脈に生じる細動脈硬化の原因となりますが、粥状動脈硬化の重大な危険因子でもあります。
心臓のポンプ作用を反映する収縮期圧も、血管の抵抗性を示す拡張期圧も、ともに動脈硬化に影響しますが、動脈硬化が進行して血管が硬くなると、収縮期血圧が高くなるにもかかわらず、臓器の血流がなかなか増えない状態になります。私たち日本人は食塩摂取量が多く、食塩感受性が強いのが特徴です。さらに早朝高血圧が多い傾向にあり、脳卒中や冠動脈疾患のリスクが高いのが特徴です。
糖尿病
糖尿病の発症には、遺伝的な素因も関与しますが、生活習慣が大きな影響を及ぼします。動脈硬化の重要な危険因子の一つです。
特に中心的な役割を担うインスリンは、インスリン受容体を介して細胞内への糖の取り込みを促進するホルモンです。その標的臓器の骨格筋、肝臓、脂肪組織でインスリン抵抗性*が生じると、血液中のインスリン濃度が上昇し、高インスリン血症となります。この悪循環が持続すると、やがて膵臓のβ細胞からのインスリン分泌が低下し、高血糖状態が悪化します。生活習慣の改善により体重を減らすことで、高インスリン血症やインスリン抵抗性が改善します。
糖尿病の三大合併症の網膜症、腎症、神経障害が、いずれも細小血管の障害に起因するのに対し、大血管の障害、すなわち動脈硬化にはさまざまな因子が関与しており、血糖だけを厳格にコントロールしても進行を防げません。しかし、糖尿病の患者さんに見られる動脈硬化性疾患は、非糖尿病の患者さんと比べて重症で、びまん性病変**が多いことが知られています。また、糖尿病に伴う神経障害の影響で、症状なく経過する頻度が高いのも特徴です。
表3 糖尿病合併症
|
|
(注)
*インスリン抵抗性:膵臓でインスリンが十分につくられても効果が発揮できない状態をいう。インスリン抵抗性があると、筋肉や肝臓が血液中のブドウ糖を取り込まないため血糖値が下がらない。
**びまん性病変:血管の狭窄などが一カ所だけでなく、広範囲にわたっている状態。
喫煙と酸化ストレス
喫煙は、がんや呼吸機能障害、消化器疾患のリスクを高めると同時に、動脈硬化を促す危険因子です。タバコを吸うことで慢性的な炎症反応を引き起こして、動脈硬化を進めると考えられています。また、喫煙により血管が収縮したり、血栓を生じやすくなったりするため、血管が詰まる塞栓症の危険が高くなるのです。喫煙者本人だけでなく、その周囲の方が副流煙の影響を受ける、受動喫煙も問題となります。
酸素分子に由来する、不安定で酸化力の強い分子群を活性酸素種(ROS:reactive oxygen species)と呼びます。ROSは、生体内では主としてミトコンドリアにおける酸化的リン酸化の過程で産生され、細胞内情報伝達や感染防御などの重要な機能を担っています。一方、過剰なROSはDNAなどを酸化して細胞を傷害しますが、生体にはもともと抗酸化、すなわち防御システムが備わっており、ROSによる酸化ストレスとのバランスが保たれているのです。
喫煙習慣のほか、血圧や血糖値、LDL-Cといった動脈硬化の危険因子は、酸化ストレスのレベルと相関することが知られています。また、脂質や塩分の多い食事の摂取も酸化ストレスを亢進させ、上記のバランスが崩れる原因となります。
加齢と家族歴
加齢は、誰しも避けることのできない現象ですが、加齢に伴うリスク因子の増悪のほかに、老化細胞の蓄積が動脈硬化の進展に寄与していると考えられています。実験レベルでは、選択的に老化細胞を除去することで老化を遅らせ、動脈硬化の進行を抑える可能性が示唆されています。
遺伝的な早期老化症であるウェルナー症候群では、20歳代から老化の兆候が現れ、早くから動脈硬化の進行が見られます。家族性高コレステロール血症(FH)でも、著しい高LDL-Cをベースとして、早期から動脈硬化が進みます。このほかにも多くの遺伝的な素因が、動脈硬化のリスクとなることが明らかにされてきています。
高尿酸血症と慢性腎臓病
高尿酸血症*と慢性腎臓病は、相互にリスクを上昇させます。高尿酸血症の患者さんでは血管内皮機能が低下しますが、尿酸値の降下により改善します。このことから、高尿酸血症では内皮機能障害を通して動脈硬化が起こる可能性が示唆されています。
慢性腎臓病は長期間にわたって腎臓の糸球体や尿細管が侵された病態です。心血管疾患の発症につながりやすく、発症後の死亡リスクが高いことも知られています。また、ネフローゼ症候群に代表されるタンパク尿が優位な慢性腎臓病では、肝臓からの超低比重リポタンパクの分泌亢進による脂質異常症が認められます。末期腎不全では、非粥状硬化性の動脈硬化も進行し、血管の石灰化も顕著となります。
(注)
*高尿酸血症:血液中の尿酸が高い状態(診断基準は7.0mg/dL以上)で、痛風や尿路結石などの原因となる。
睡眠時無呼吸症候群
日本における睡眠時無呼吸の患者さんは、必ずしも肥満を伴っていませんが、生活習慣病の合併頻度は高く、多くの因子を介して動脈硬化を促進すると考えられています。
腸内細菌
最近の研究で、腸内細菌は宿主(しゅくしゅ)*の生体機能に影響し、さまざまな疾患に関与することが知られています。一部の腸内細菌の代謝物が、動脈硬化の進展や抑制に関係していることが示されてきており、腸内細菌叢(そう)**への介入が、動脈硬化予防の新たな治療戦略となる可能性が期待されています。
(注)
*宿主(しゅくしゅ):ウイルスや細菌などに寄生される側の生物。
**腸内細菌叢(そう):腸内フローラともいう。人の腸内には多種多様な細菌が存在するが、それら個々の腸内細菌が集まって複雑な微生物生態系を構築しており、腸内細菌叢と呼ばれる。
女性ホルモン
若年女性は、同年代の男性と比較して動脈硬化性疾患の発生頻度が少ないことが知られています。閉経に伴ってこの性差が消失し、閉経後のエストロゲン投与により動脈硬化性疾患の発症が抑えられることから、エストロゲンには抗動脈硬化作用があるのではと考えられています。これに関連して、基礎研究ですが、エストロゲンには細胞老化の抑制作用があることが明らかにされてきています。ただし、閉経後のホルモン補充療法については、乳がんや静脈血栓症などのリスクを高めることが示されています。
4. 動脈硬化から起こる重い病気は?
動脈硬化が原因となってさまざまな疾患を引き起こします。ときとして致命的となり、また生活の質を大きく損ねることがあります。それらの疾患を予防するために、動脈硬化の進行を抑えることが重要になります。
虚血性心疾患
粥状動脈硬化は、直径が数mm以上の太い血管、すなわち大動脈、冠動脈、脳底動脈、大脳動脈などに生じます。血管壁に生じた動脈硬化巣(プラーク)が徐々に厚くなると、血管の内腔が狭くなり、心臓の冠動脈に生じれば狭心症を発症することになります。やがてプラークが破裂すると、ここに血小板が凝集して血栓がつくられ、急性冠症候群、すなわち急性心筋梗塞ないし不安定狭心症となるのです。
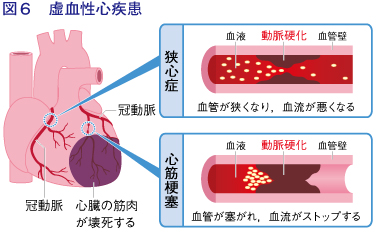
粥状動脈硬化巣の形成・進展は、血中のコレステロールの沈着とマクロファージによる貪食を伴う炎症反応が中心となり、脂質異常の影響が大きく、高血圧の影響は比較的少ないと考えられています。
大動脈弁狭窄症
従来、多くを占めていたリウマチ性の心臓弁膜症は激減し、高齢化による加齢変性に伴う弁膜症、特に大動脈弁狭窄症が増えています。動脈硬化と同様のリスク因子によって、弁尖が石灰化する進行性の疾患であり、狭心症状や失神、心不全などの症状を呈するのが特徴です。最近では、高齢者に対してカテーテルでの弁置換治療(TAVI)が行われています。
脳卒中と、血管性認知症・うつ病
細動脈硬化は、大脳の基底核部に分布する血管径0.2mm程度の細い動脈に起こります。通常、プラークや血栓の形成は見られません。中膜の壊死によって小動脈瘤となり、それが破裂して脳出血を生じたり、閉塞してラクナ梗塞になったりします。原因として高血圧の影響が大きいと考えられています。
また、アテローム血栓性脳梗塞は、より大きな血管が閉塞して起こり、重症化することが多く、急性期には血栓溶解療法、慢性期には血管内治療が行われます。
また、動脈硬化に基づく脳血管障害は、血管性認知症やうつ病の原因ともなります。アルツハイマー型認知症と血管性認知症は、元来は別の疾患としてとらえられていました。しかし両者の危険因子の多くは共通し、それぞれが合併したり、相互に影響し合ったりしている可能性が示唆されています。同様に、うつ病と脳血管障害についても、相互に関連した病態であると考えられています。
閉塞性動脈硬化症
閉塞性動脈硬化症は、おもに脚の血管で動脈硬化が進み、血管が狭くなったり、詰まったりする病気です。下肢への血流が悪くなることで、栄養や酸素を送ることができなくなり、さまざまな障害が現れます。
一般に、ABI(足関節上腕血圧比)が低いほど重症度が高く、心筋梗塞や脳卒中などの合併も多くなり、死亡率も高くなります。特に糖尿病の患者さんでは、急速に進行して組織壊死から下肢切断になることもあります。重症の場合は、カテーテルを用いた血管内治療(EVT:endovascular treatment)や、外科的な内膜摘除術、バイパス手術が行われます。
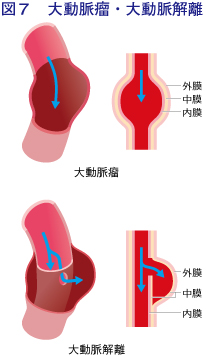
大動脈瘤と大動脈解離
大動脈瘤や大動脈解離は、必ずしも動脈硬化だけで生じるものではなく、動脈壁の脆弱化など、発症には別の要因も関与していると考えられています。結合織疾患*や血管炎、感染を契機に生じることもあります。
大動脈瘤は、動脈壁の一部に構造変化が生じて、正常径の1.5倍を超えて拡張した状態です。これといった症状がなく経過し、検診などで偶然に発見されることも少なくありません。壁の一部が嚢(のう)状に突出したものや、一定のサイズを超えて拡大傾向にあるものは、破裂の危険があり侵襲的治療**の対象となります。
大動脈解離は、動脈壁が中膜のレベルで動脈の走行に沿って二層に分かれて、本来の動脈内腔(真腔)と新たに生じた壁内腔(偽腔)とが、内膜を中心としたフラップで隔てられ、二腔になった状態です。突然の胸痛や背部痛で発症することが多く、心臓付近に解離が及ぶ場合は緊急手術が必要になります。
(注)
*結合織疾患:皮膚や関節、血管などの結合組織が炎症を起こす病気で、多くの臓器にダメージを与える。
**侵襲的治療:体を傷つける手術や体に負担となる医療処置。
5. 動脈硬化がわかる検査は?
動脈硬化が進行する過程では、まず内皮機能が傷害され、血管を拡張するはたらきが低下します。血管内皮機能の測定は、動脈硬化自体の評価だけでなく、病態の理解、そして治療効果の判定や予後の予測など、多くの局面で有用です。現在、汎用されているのは、血流依存性血管拡張反応(FMD:flow-mediated dilation)と指尖反応性充血指数(RHI:reactive hyperemia index)です。FMDは、超音波を用いて四肢の虚血反応性充血前後の血管径変化を測定することで算出されます。血管径2~6mmの血管の内皮機能を反映し、7%以上が正常とされています。RHIは、反応性充血後の指尖容積脈波を測定することで算出されます。指の皮膚血管の内皮機能を反映していると考えられ、2.1以上が正常とされています。
そのほかによく行われる簡便な検査としては、足関節上腕血圧比(ABI:ankle brachial index)と脈波伝搬速度(PWV:pulse wave velocity)があります。現在では、両者を同時に自動測定できる装置が普及しています。ABIは、足関節の血圧(後脛骨動脈と足背動脈の高い方)を、左右の上腕血圧の高い方で除することで求められます。0.9?1.4が正常範囲とされ、0.9以下の場合には末梢動脈疾患(PAD:peripheral arterial disease)が疑われます。ただし、上肢の血圧低下や左右差などの異常がある場合は、結果が正常範囲であっても解釈に注意が必要です。また、動脈の石灰化が強い場合には、1.4よりむしろ高くなることがあります。PWVは、心臓から2カ所(例えば上腕と足首)までの距離の差を、それぞれで測定した脈波の立ち上がりの時間差で除することで求められ、動脈の硬化度の指標となります。
動脈硬化が進行すると、形態に変化が見られるようになります。まず内膜が肥厚して、内膜中膜複合体厚(IMT:intima-media thickness)が増大するのです。さらに進展すると、プラークができ、血管が狭くなったり、詰まったりします。頸動脈エコーでは、非侵襲的に初期の形態変化のIMTの肥厚度、進行したプラークの性状や血管の狭窄度を評価することが可能です。IMTは動脈硬化の進展度を示し、肥厚するほど全身の動脈硬化も進行していると考えられます。狭窄度についてはドップラー法を用いた評価がよく、収縮期最大血流(PSV)1.3m/秒が50%狭窄、2m/秒が70%狭窄に相当すると推定されます。
眼底は、人体の中で唯一、血管の状態をそのまま観察できる場所で、動脈硬化の程度を判定できます。ただし、正確な判定には、散瞳処置*や眼底観察のための装置が必要になります。
一方、侵襲的ですが、心臓カテーテルやいろいろな血管内デバイスを用いて冠動脈の状態が評価されます。血管内エコー(IVUS:intravascular ultrasound)は1990年代から使用されており、組織深達度に優れ、血管径の測定、冠動脈プラークの体積や石灰化の評価に有用です。光干渉断層法(OCT:optical coherence tomography)では組織に近赤外線を照射し、その性状、例えば脂質性プラーク・線維性プラーク・石灰化プラークを高解像度で判別できます。血管内視鏡(coronary angioscopy)は血管内腔の表面を直視下で観察でき、病変の定量的評価には不向きですが、プラークの色調やステント留置後の内膜などの評価が可能です。
(注)
*散瞳処置:目の瞳孔(ひとみ)が開くことを散瞳といい、散瞳薬を使って強制的に瞳孔を開いたままにすること。
6. 動脈硬化を進めないためには?
多くの疾患と同様に動脈硬化も、生じたものを元に戻すのは容易ではなく、進行する前の予防が肝心です。加齢や遺伝的素因など防ぎようのない要素もありますが、正しい知識を身につけ、健康診断を欠かさずに受診し、動脈硬化のリスクがある場合には、それらが悪くならないように、また他のリスクが生じないように努める必要があるでしょう。日々の食事や運動のほか、薬が処方されているときには定期的な服薬など、普段の生活習慣が重要です。
具体的には、一年を通じて脱水を予防するため、日中は1時間に100mL程度の飲水を心がけるようにします。塩分を控えるには、酢などの酸味や胡椒などの香辛料でアクセントをつけ、塩や醤油は下味でなく後からつけるようにすると、より少量でも効果的です。食材としては、肉よりも魚介類を増やし、炭水化物を控えめにして、野菜やオリーブオイルを増やすようにします。
身体活動については、ややつらいと感じる強度の運動を、うっすら汗ばむまで、20?30分程度続けると効果的です。腰や膝が悪い場合には、プールなどでの水中歩行もよいでしょう。体調に合わせて、週に3回程度行うようにします。屋内で過ごす場合は、8時間以上の座位を避けるよう心がけます。また、体重や腹囲の測定は、誰でも取り組みやすく、有用な自己管理法の一つです。
血圧の異常を指摘されている場合には、自宅での測定が重要になります。診察室で測定された血圧は、普段の状態を反映していないことがしばしばあり、また診察以外の時間帯の血圧を知ることができないからです。
よく推奨されるものに禁煙や節酒がありますが、これを意識しすぎると、かえってストレスをため込むことになります。注意してください。個々人のライフスタイルやリスクなどに応じて、目標を設定するのが望ましいでしょう。
また、適度な休養や睡眠も大事ですが、夜間の不眠を過度に心配しすぎるのもよくありません。眠らなければと意識しすぎて、かえって休息が十分にとれていない方がしばしば見受けられます。加齢とともに長時間の睡眠は難しくなります。いたずらに睡眠薬などに頼るのではなく、静かな環境で安静を保てば、たとえ眠れなくとも心身を休められることになり、自然と解決されることも多くなります。






